从 19 世纪末开始,科学家们就从各种生物体(例如人类、小鼠、猪、鸡和植物)中分离出自然环境中的细胞,并将它们置于体外(拉丁语“玻璃中")中。 ) 文化。实验细胞是从许多不同的组织和器官中提取的,例如肠、肾、血液、脑、乳腺和许多癌症实体。
体外培养细胞的目的是模拟培养箱内的体内(拉丁语“活体中")条件,或者在进行活细胞成像时甚至在显微镜下模拟体内条件。每种细胞类型都需要定制培养参数,以实现最佳的健康、活力和生长。对于所有实验,保持条件无菌、均质和可重复至关重要,以获得可比较的结果。
为了保持细胞处于增殖状态,并防止它们达到过度汇合,以规定的时间间隔进行传代非常重要。必须定期进行细胞传代,以保持细胞处于培养状态、实现体积放大或在实验开始时接种它们。该过程也称为细胞分裂或传代培养。除其他因素外,传代的最佳时间取决于增殖率以及所需的细胞数量。每种细胞类型的确切裂解方案都是b的。一般来说,贴壁细胞使用蛋白水解酶(主要是胰蛋白酶/EDTA)从基质上分离,这对于消化其蛋白质附着键是必需的。接下来,将细胞匀浆、计数并接种到新容器中,从而将传代次数增加一倍。
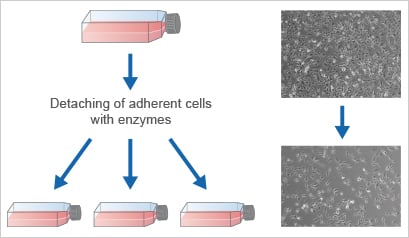
传代/传代=将细胞转移到新鲜的培养皿和生长培养基中
一些细胞系,例如 HeLa 或其他缺乏细胞周期调节的癌细胞,可以无限传代而不丧失分裂能力(永生细胞系)。此外,某些胚胎细胞类型或多能干细胞也是如此。其他细胞,特别是原代细胞(例如,从成体器官中分离的细胞),在几次传代后将失去这种能力,因为它们要么经历衰老,要么分化,要么死亡。因此,使用具有相似传代数的细胞进行可重复的实验非常重要。
对于细胞接种,需要选择适合各自细胞类型、细胞培养容器和实验装置的密度。如果密度太低,细胞可能会由于生长因子释放到培养基中不足而停止生长。缺乏细胞间和细胞间基质通讯的单个细胞甚至可能因一种特殊形式的程序性细胞死亡(称为失巢凋亡)而死亡。如果接种密度太高,细胞可能在很短的时间内就已经达到过度汇合。这会导致增殖受损和细胞与基质分离,从而导致实验条件不可重复。
标准细胞类型可在 –80°C 下短期保存,或在液氮中长期保存。为此,需要对细胞进行胰蛋白酶化、均质化和离心,然后使用特殊的冷冻介质进行冷冻。为了对抗此过程引起的细胞应激,建议使用具有高回收率的冷冻介质。此外,解冻过程必须快速进行(例如,在37°C的水浴中),然后将细胞转移到培养基中并将其放入培养箱中以创造生理条件。
hihi用u