1.糖基化定义
糖基化是在酶的控制下,蛋白质或脂质附加上糖类的过程,发生于内质网和高尔基体等部位。在糖基转移酶作用下将糖转移至蛋白质,和蛋白质上的氨基酸残基共价结合。蛋白质经过糖基化作用,形成糖蛋白。糖基化是对蛋白的重要的修饰作用,有调节蛋白质功能作用。糖基化的结果使不同的蛋白质打上不同的标记,改变多肽的构象和增加蛋白质的稳定性。
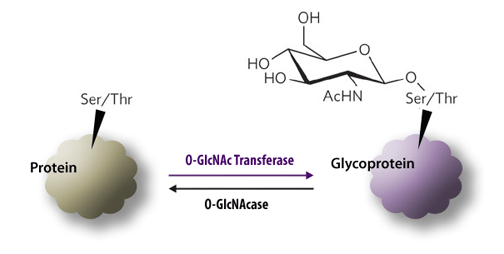
蛋白糖基化
2.糖基化修饰的作用及类型
作为一种普遍存在的翻译后修饰,蛋白质糖基化影响蛋白的功能,在许多生物过程中起着重要的作用,如免疫保护、病毒的复制、细胞生长、细胞与细胞之间的黏附、炎症的产生等。很多蛋白,如转录因子、热休克蛋白、核小孔蛋白、RNA聚合酶Ⅱ、致癌基因翻译产物、酶等,都发现了糖基化这种翻译后修饰方式。
糖基化的作用可概括为3点:①使蛋白质能够抵抗消化酶的作用;②赋予蛋白质传导信号的功能;③某些蛋白只有在糖基化之后才能正确折叠。糖基一般连接在4种氨基酸上,分为两种:N-连接的糖基化(N-linked glycosylation):与天冬酰胺残基的NH₂连接,连接的糖为N-乙酰葡糖胺;O-连接的糖基化(O-linked glycosylation):与Ser、Thr和Hyp的OH连接,连接的糖为半乳糖或N-乙酰半乳糖胺,在高尔基体上进行O-连接的糖基化。
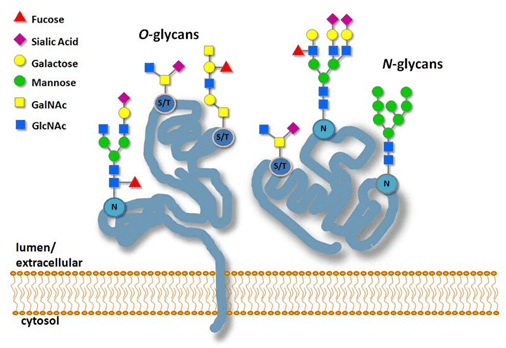
N-连接和O-连接的糖基化
3.蛋白质的糖基化分析
蛋白质的糖基化分析主要包括以下几个方面:糖基化是否发生;在哪里发生了糖基化;糖基化的类型是什么;糖链中各种糖的种类和含量;糖链的一级结构等。应用于糖链结构解析方面的质谱技术和核磁共振技术,各种技术有其各自优缺点,在应用中可以互补。目前糖分析的研究技术主要分为两大部分:分离富集亲和技术、糖蛋白鉴定/糖基化位点确定方法。其中分离富集亲和技术包括:①凝集素亲和技术;②肼化学富集法;③亲水色谱法;④β- 消除米氏加成反应,糖蛋白鉴定 / 糖基化位点的确定方法包括:① PNGase F酶法;②Endo H酶法;③三氟甲基磺酸(trifluoromethananesulphonic acid,TFMS)法。以下着重介绍一下分析糖链结构的质谱法和核磁共振法。
(1) 质谱法
经典质谱分析技术通常采用酶法或者化学的方法把糖链与肽链分开,再分别在氨基酸序列水平或者糖链水平进行进一步的分析。有研究采用膜上样品直接质谱分析技术,这种技术需要的样品量小,因此1个2-D胶上的蛋白质点可以被分为若干份进行处理,一部分用蛋白酶进行酶解,用于蛋白质的鉴定,另一部分用糖苷酶进行酶解,用于寡糖链结构的研究,再将这两部分结合起来,就可以得到糖肽的信息。
(2) 核磁共振法(NMR)
目前,NMR技术已成为糖链立体化学结构分析的方法之一,可确定糖链的构型、连接位置、分支和微观多样性。Kogelberg等从人乳中分离出一种未果糖型和3种不同果糖型的寡糖。通过ES-MS和NMR的结合使用确定其结构特点,通过ES-MS/MS分析阐明其分支类型、 血型相关刘易斯决定簇、部分序列和寡糖链连接情况,然后通过甲基化分析和1H-NMR确定其全序列。再鉴定出三种新的糖链结构:未果糖结构,单果糖结构和三果糖结构。但NMR测定糖的讯号峰重叠严重,解析较难,灵敏度不高,而且多维NMR需要毫克级样品,这对多数糖复合物中的微量糖链是很难达到的。
4.小结
蛋白质糖基化是沟通蛋白质和糖这二大类生物大分子的桥梁。在蛋白质组学水平进行蛋白质糖基化研究有助于认识蛋白质糖基化发生、发展的规律及其在整个生命过程中的生物学意义,有助于从基因组-蛋白组-糖组这样一个宏观的综合的层面上观察分析生命现象,达到对生命现象更本质的认识,进而有助于发病机制的阐明,为疾病的早期诊断、治疗等提供指导。